Het zilverachtige cadmium behoort tot de toxische ‘zware metalen’. Het wordt opgenomen door planten en accumuleert in ons lichaam. Cadmium verstoort de werking van de nieren en kan kanker veroorzaken. Het gebruik van cadmiumverbindingen, bijvoorbeeld als pigment voor felgekleurde bierkratten (cadmiumsulfide), is aan banden gelegd. Metallisch cadmium wordt nog wel toegepast in batterijen en in de metaalindustrie. Cadmium heeft een relatief laag smelt- en kookpunt en wordt toegepast in legeringen die bij een zeer lage temperatuur smelten (onder andere in sprinklersystemen). Verbindingen van cadmium met zwavel en telluur zijn halfgeleiders voor onder andere zonnepanelen.
Symbool
Cd
Protonen/elektronen
Groep
Isotopen
106Cd, 108Cd, 110Cd, 111Cd, 112Cd, 113Cd, 114Cd, 116Cd
Periode
5
Elektronenconfiguratie
[Kr] 4d105s2
Blok
d
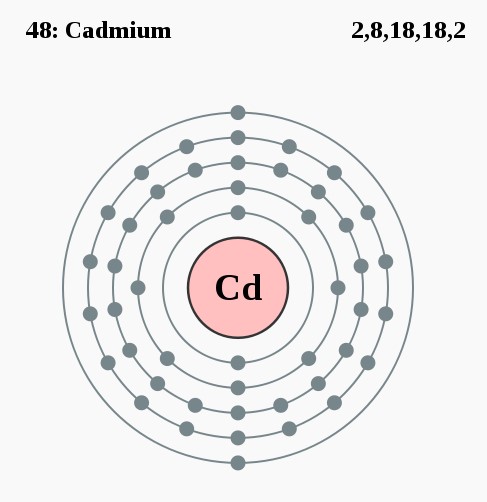
Elektronencofiguratie Bohr
2,8,18,18,2
Bij kamertemperatuur
vast
Elektronegativiteit
1,7 (Pauling)
Dichtheid
8690 kg m-3
Atoomstraal
149 . 10-12 m
Smeltpunt
321 oC (594 K)
Relatieve atoommassa
112.411
Kookpunt
767 oC (1040 K)
Soortelijke warmte
234 J kg-1K-1
Warmtegeleidingscoëfficiënt
92 W m-1 K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Zonnecellen
Zonnecellen met cadmiumtelluride (CdTe) en cadmiumsulfide (CdS) zijn vooral in grote, multi-kilowatt systemen aan een opmars bezig. Ze concurreren in deze toepassing zowel in prijs als efficiëntie met de bekende zonnepanelen gebaseerd op silicium. De cellen zijn opgebouwd uit meerdere dunne lagen, desgewenst aangebracht op een flexibel dragermateriaal.

Sprinkler
Cadmium heeft al een relatief laag smeltpunt, maar in combinatie met andere metalen zijn legeringen te maken die bij nog veel lagere temperaturen vloeibaar worden. In sprinklerinstallaties gebruikt men een smeltdraad of smeltplaatje uit een mengsel van bismut, lood, cadmium, en tin in een verhouding van ongeveer 4:2:1:1 Bij een temperatuur rond 50 °C smelt het metaal en stroomt het water door de sprinkler-sproeikop.
Kernreactor regelstaaf
Cadmium (113Cd) heeft een goed adsorptievermogen voor neutronen en is daardoor – gelegeerd met andere metalen zoals indium, zilver en seleen – geschikt als regelstaaf in kernreactoren. Ook staven van cadmiumfluoride (CdF2) worden gebruikt om de neutronen dichtheid te regelen.

Lichtmeter
Lichtmeters (bijvoorbeeld in de fotografie) zijn gebaseerd op materialen die elektronen afgeven als er licht opvalt, of waarvan de weerstand verandert. Cadmiumsulfide (CdS), -selenide (CdSe) en -telluride (CdTe) zijn halfgeleidermaterialen die hiervoor geschikt zijn. Cadmiumsulfide wordt vanwege deze eigenschap ook toegepast in fotokopieermachines.
Oplaadbare batterij
In de oplaadbare nikkel-cadmium batterij vindt de stroomlevering plaats via de volgende reactie:
Bij opladen verloopt de reactie in omgekeerde volgorde. De ontladingsspanning bedraagt ca. 1,2 V.

Voor toepassingen waarbij een iets hogere spanning vereist is en wat meer vermogen is de batterij minder geschikt. Een nadeel is ook het “geheugen” van de batterij, dat er voor zorgt dat bij voortdurend te vroeg opladen de effectieve gebruikstijd sterk terugloopt. De batterij heeft daarom flink terrein moeten prijsgeven aan de nikkel-metaal hydride en de lithium-ion batterij.
Bescherming tegen corrosie
Net als zink beschermt een dun laagje cadmium het onderliggende metaal tegen oxidatie. Vooral in veeleisende toepassingen, zoals bevestigingsmaterialen in de luchtvaart geeft men de voorkeur aan cadmium boven zink vanwege de superieure eigenschappen.
Pigment: email, keramiek, olieverf
Cadmiumsulfide (CdS) is een geel pigment, bekend als cadmiumgeel. Het zeer stabiel en lichtecht. Schilders als Van Gogh, Monet en Matisse maakten er gebruik van. Het kwam pas in de tweede helft van de negentiende eeuw beschikbaar. De aanwezigheid van het pigment in schilderijen van een eerdere datum duidt op vervalsing.

Het gebruik van cadmiumsulfide in verf en kunststof (denk aan de bekende gele bierkratten) is teruggedrongen vanwege de gezondheidsrisico’s.
Meer toepassingen
Als element en in legeringen
- Elektrische contacten (met Ag, Cu of Zn)
- Laag smeltende legeringen voor soldeer (cadmium is een zeer zacht metaal; het is gemakkelijk met een mes te snijden)
In verbindingen
- Halfgeleiders (CdO, CdSe, CdTe)
- Katalysator voor het hydrogeneren onverzadigde vetten (CdO)
Naam & ontdekking
Naam
De naam cadmium is afgeleid van het Griekse kadmeia of het Latijnse cadmia, de oude naam voor calamien of galmei. Dat is een zinkerts gedolven in de buurt van de stad Thebe en vernoemd maar de stichter van die stad, Kadmos (afstammeling van Zeus en broer van Europa). Cadmium is voor het eerst aangetroffen in zinkerts.

Ontdekking
De Duitse chemicus Friedrich Stromeyer (foto) ontdekte cadmium in 1817 in calamien (zinkcarbonaat). Omdat de kleur van sommige kristallen wat afweek, (lichtgeel i.p.v. wit) vermoedde men dat er sporen ijzer aanwezig waren. Bij onderzoek bleek het mineraal geen ijzer te bevatten, maar een tot dan onbekend element.
Voorkomen
Voorkomen
Cadmium heeft een aandeel van 1,5.10-5 % van de aardkost (op basis van gewicht). Het staat op plaats 66e in de rangorde van voorkomen.
De belangrijkste mineralen zijn greenockiet (CdS, foto) en otaviet (CdCO3). De meeste zinkertsen bevatten ook cadmium. De EU heeft met de Critical Raw Materials Act in 2022 het element cadmium op de lijst van schaarse en strategische grondstoffen gezet.

Winning
De belangrijkste wingebieden liggen in Rusland, Kazachstan, China, Japan, Namibië, Canada, Mexico en Australië. In Duitsland en Frankrijk wordt op zeer bescheiden schaal cadmium gewonnen; vroeger ook in België, samen met de exploitatie van zinkerts.
Het merendeel van het geproduceerde cadmium is afkomstig uit zink-, lood- en koperertsen, en uit vliegas.
Bereiding
Bereiding
Vroeger
Cadmium is uit calamien te bereiden door isolatie van het cadmiumoxide (na behandeling met ammoniumcarbonaat en zinkcarbonaat). Dit is vervolgens te reduceren met koolstof (bij circa 900 °C).

Tegenwoordig
Cadmium wordt vooral bereid uit zinkertsen, die kleine hoeveelheden cadmiumverbindingen bevatten. Na roosten van het erts wordt de verkregen stof gesmolten en scheidt men de cadmium- en zink verbindingen. Na het oplossen van cadmiumsulfaat in zwavelzuur is via elektrolyse metallisch cadmium te verkrijgen. Daarbij wordt een loden anode gebruikt en een roterende aluminium kathode.