Het grijswitte lichtmetaal magnesium behoort tot de aardalkalimetalen. Het komt zowel in de aardkorst als in zeewater veel voor. Magnesium brandt met een zeer fel, wit licht. Het vervult een belangrijke functie in de chemie van het leven. Magnesium is aanwezig in alle cellen en speelt een rol bij allerlei cruciale biochemische processen, van de cellulaire energievoorziening tot DNA-synthese. Het menselijk lichaam bevat 0,027% magnesium. Ieder chlorofyl molecuul (bladgroen) bezit een magnesium-ion.
Symbool
Mg
Protonen/elektronen
Groep
Isotopen
24Mg, 25Mg, 26Mg
Periode
3
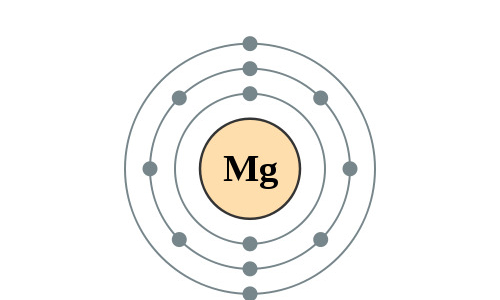
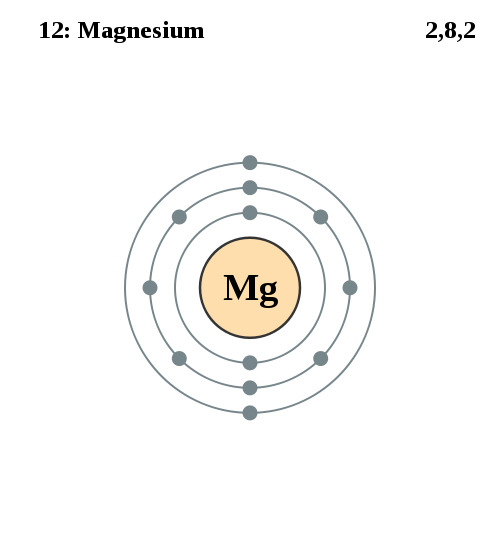
Elektronenconfiguratie
[Ne] 3s2
Blok
s
Elektronencofiguratie Bohr
2,8,2
Bij kamertemperatuur
vast
Elektronegativiteit
1,2 (Pauling)
Dichtheid
1740 kg m-3
Atoomstraal
160 . 10-12 m
Smeltpunt
650 oC (923 K)
Relatieve atoommassa
24.305
Kookpunt
1090 oC (1363 K)
Soortelijke warmte
1026 J kg-1K-1
Warmtegeleidingscoëfficiënt
156 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Lichtkogel
Lichtkogelfakkels zijn gevuld met zuiver magnesiumpoeder. Het verbrandt bij 500 oC met een verblindend licht tot magnesiumoxide (in de vorm van witte rook). De benodigde zuurstof is afkomstig van verbindingen als mangaandioxide (MnO2), kaliumchloraat (KClO3) en kaliumpermanganaat (KMnO4). Deze worden met het magnesiumpoeder vermengd.

Velg
De auto-industrie is altijd op zoek naar gewichtsbesparing, omdat lichtere auto’s minder brandstof gebruiken. Je vindt daarom magnesiumlegeringen in velgen, deuren, rem- en koppelingssysteem en luchtinlaat. Het gaat om legeringen met bijvoorbeeld aluminium en zink (resp. 9 % en 1 %) of zeldzame aardmetalen en zirkonium (resp. 3,3 % en 0,7 %). Ook in de wielen van rolstoelen is soms magnesium te vinden.
Vliegtuig
In de luchtvaart is gewichtsbesparing nog belangrijker dan bij auto’s. Magnesium is niet alleen zeer licht maar verbetert ook de materiaaleigenschappen. Het gehalte aan magnesium is afhankelijk van de toepassing. Vliegtuigvleugels bestaan vaak uit legeringen met magnesium (Mg), aluminium (Al) en zink (Zn). Deze legeringen zijn tot 20 % lichter dan puur aluminium en goed bestand tegen corrosie. Ook motoronderdelen, romp, landingsgestel en landingstrap worden van magnesiumlegeringen gemaakt. Ze bestaan uit magnesium met 6 – 10 % aluminium, 1 – 3 % zink en 0,2 % mangaan, of uit magnesium met 3,3 % zeldzame aardmetalen en 0,7 % zirkonium.

Ruimtevaart
Voor de Saturnusraket, gebruikt bij de maanexpedities, werd een legering gebruikt uit magnesium met 14 % lithium en 1,25 % aluminium. De dichtheid van deze legering is slechts 1350 kg/m3 – dat is maar liefst vier keer lichter dan staal.
Racefiets
Hoewel koolstofvezel inmiddels de standaard is geworden voor de vervaardiging van lichte en sterke frames voor racefietsen, zijn er ook frames te koop uit magnesiumlegeringen. De materiaaleigenschappen zorgen onder andere voor hoge controle bij afdalingen.
Turnpoeder
Turnpoeder, ook wel magnesiumpoeder genoemd, bestaat uit basisch magnesiumcarbonaat (Mg(OH)2.3MgCO3.3H2O). Het wordt in blokken in de handel gebracht en bij sporten zoals turnen gebruikt om gladde handen stroef te maken. Het neemt lichaamsvocht op.

Meer toepassingen
Als element en in legeringen
- Frame van mobiele telefoon, fototoestel, laptop computer (6 – 10 % Al, 1 – 3 % Zn)
- Metaalbescherming (tegen corrosie)
- Ontzwaveling van ruw ijzer en staal (ook in legering met Al)
- Thermische lans (bijvoorbeeld voor ‘snijden’ van beton)
- In krukassen van treinstellen, trams en bussen (Al, Mg)
In verbindingen
| Antiklonteringsmiddel (o.a. voor zout) | MgHPO4 |
| Badzout | MgSO4 |
| Bladbemesting | Mg(NO3)2 |
| Cosmetica | Mica, talk |
| Dieetzout | Mg-citraat |
| Geneesmiddel | |
| - tegen allergie, kramp en astma | Mg-gluconaat |
| - tegen matheid, voor het opwekken van de eetlust | MgO2 |
| - laxeermiddel | MgCl2 |
| - activeren van enzymen | Div. org. Mg-verb |
| Keramiek | Mg2SiO4 , MgO |
| Leerlooien | MgSO4 |
| Levensmiddelentoevoeging | |
| - E 580 | Mg-gluconaat |
| - E 572 | Mg-stearaat |
| Meststof | MgCO3, MgNH4PO4, MgO, MgSO4 |
| Ontdooiingsmiddel (de-icer) | MgCl2 |
| Ontzwavelen van gassen | Mg(OH)2 |
| Stabilisator voor crème en zalf | Mg-stearaat |
| Vlamwerend middel (onder andere in textiel) | MgSO4 |
| Vloeimiddel voor het solderen van lichte metalen | MgF2 , MgSiF6 |
| Waterzuivering (vlokmiddel) | Mg(OH)2, MgSO4 |
Naam & ontdekking
Naam
Magnesium is genoemd naar Magnesia, een gebied in de Griekse provincie Thessalië en ook de naam van het daar gevonden magnesiumhoudende mineraal (magnesiumoxide). In het Nederlands is dit bekend als ‘bitteraarde‘. Ook de naam magneet is afkomstig van Magnesia.
Ontdekking
In 1755 ontdekte de Frans-Schotse natuur- en scheikundige Joseph Black (foto) magnesium als nieuw element in magnesia. Het onderscheidde zich van de bekende stoffen kalk, kali en gips.

Voorkomen
Voorkomen
Magnesium speelt een belangrijke rol in de natuur. Het is aanwezig in alle cellen en speelt een rol bij allerlei cruciale biochemische processen, van de cellulaire energievoorziening tot DNA-synthese. Het menselijk lichaam bevat 0,027% magnesium. Ieder chlorofyl molecuul (bladgroen) bevat een magnesium-ion.
Na de voor de hand liggende elementen waterstof, zuurstof, chloor en natrium is magnesium het meest voorkomende element in zeewater, met een aandeel van 0,13%. Bij indampen ontstaan onder andere de zouten magnesiumchloride (MgCl2) en magnesiumbromide (MgBr2). Ook in zoutmeren is magnesium te vinden.
Magnesium behoort tot de top tien van elementen in de aardkorst. Het staat op plaats zeven met een aandeel van 2,33 %.

Het komt voor in vele mineralen, zoals in:
| Bischofiet | MgCl2.6H2O |
| Boraciet | Mg3B7O13Cl |
| Bruciet | Mg(OH)2 |
| Carnalliet | KMgCl3.6H2O |
| Dolomiet | CaMg(CO3)2 |
| Epsomiet | MgSO4.7H2O |
| Kieseriet | MgSO4.H2O |
| Langbeiniet | K2Mg2(SO4)3 |
| Magnesiet (foto) | MgCO3 (ook wel bitterspaat genoemd) |
| Mica | {Na,K,Ca,Mg}{Al,Mg,Fe,Li}2-3{Si,Al}4O10{OH,F}2 |
| Sellaite | MgF2 |
| Serpentijn | (Mg,Fe+2,Ni)3Si2O5(OH)4 |
| Spinel | MgAl2O4 |
| Tachyhydriet | CaMg2Cl6.12H2O |
| Talk of speksteen | Mg3Si4O10(OH)2 |
In zoutmijnen is magnesium aanwezig in de dubbelzouten kainiet (MgSO4. KCl.3H2O) en carnalliet (KCl.MgCl2.6H2O).
Winning
De belangrijkste wingebieden van magnesium – meestal in de vorm van mineralen, maar ook uit zeewater – worden gevonden in Turkije, China, de Verenigde Staten van Amerika, Noord-Korea, Slowakije, Rusland, Kazachstan, Oekraïne, Oostenrijk, Griekenland, India, Spanje, Brazilië, Rwanda, Democratische Republiek Congo, Australië, Canada, Frankrijk, Italië, Palestijn, Jordanië en Noorwegen. De EU heeft met de Critical Raw Materials Act in 2022 magnesium en talk op de lijst van schaarse en strategische grondstoffen gezet.
Bereiding
Bereiding
Vroeger
De Britse scheikundige Humphry Davy isoleerde magnesium in 1808 via elektrolyse van gesmolten magnesiumzouten (waaronder watervrij magnesiumchloride).
Tegenwoordig
Magnesium wordt gewonnen uit mineralen of uit zeewater.

Mineralen zoals dolomiet (MgCa(CO3)2, foto) worden eerst omgezet in magnesiumoxide. Zeewater geeft het magnesium prijs via de toevoeging van kalk, waardoor magnesiumhydroxide neerslaat. Dat wordt vervolgens omgezet in magnesiumchloride of -oxide.
Het magnesiumoxide is in magnesium om te zetten via reductie in een elektrische oven met silicium bij 1100 °C. Uit magnesiumchloride is het magnesium vrij te maken via elektrolyse in gesmolten toestand (bij 700 oC).
Zuivering van het verkregen ruwe magnesium vindt plaats via destillatie in vacuüm of in een atmosfeer van argon.