Rubidium is een zilverwit metallisch element uit de groep van de alkalimetalen. Het is één van de meest elektropositieve en alkalische elementen. Rubidium ontbrandt spontaan in lucht en kent een zeer heftige reactie met water. Het kan amalgaam vormen met kwik en legeringen met goud, cesium, natrium en kalium. Het kleurt een vlam gelig paars. Atomen van het isotoop rubidium-87 werden gebruikt om het Bose-Einstein condensaat aan te tonen – een ultrakoude aggregatietoestand met super vloeibare eigenschappen, die op macroscopische schaal kwantumeffecten vertoond.
Symbool
Rb
Protonen/elektronen
Groep
Isotopen
85Rb, 87Rb
Periode
5
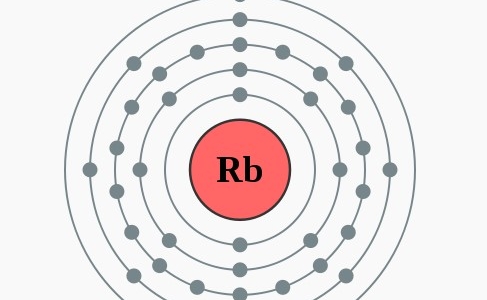
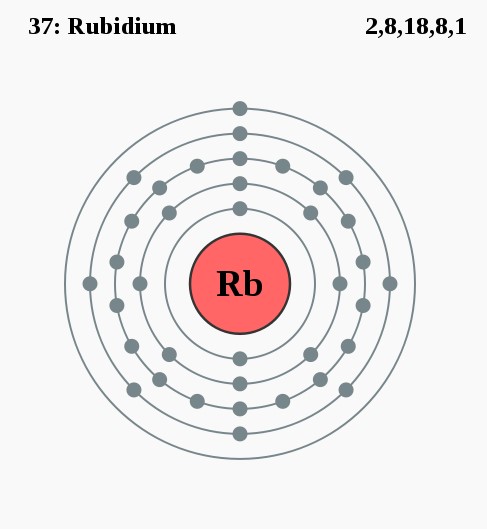
Elektronenconfiguratie
[Kr] 5s2
Blok
s
Elektronencofiguratie Bohr
2,8,18,8,1
Bij kamertemperatuur
vast
Elektronegativiteit
0,9 (Pauling)
Dichtheid
1530 kg m-3
Atoomstraal
244 . 10-12 m
Smeltpunt
39oC (312 K)
Relatieve atoommassa
85.468
Kookpunt
688 oC (961 K)
Soortelijke warmte
363 J kg-1K-1
Warmtegeleidingscoëfficiënt
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Foto-elektrische cel
Rubidium kan gevonden worden in legeringen, bijvoorbeeld met cesium, als lichtgevoelige laag in fotocellen. Onder invloed van licht komen uit rubidium en cesium elektronen vrij.

Gasvanger vacuümbuis
Rubidium reageert gemakkelijk met gassen als zuurstof en stikstof. Dat maakt het zeer geschikt als zogenaamd getter materiaal (gasvanger) in vacuümbuizen. Omdat rubidium de laatste sporen lucht bindt, kan een hoogwaardig vacuüm ontstaan. De levensduur van deze buizen neemt er door toe. Je vindt zulke vacuümbuizen onder andere in professionele radioapparatuur, versterkers en gelijkrichters.
Medisch onderzoek
Het radioactieve 86Rb-isotoop dient als tracer bij onderzoek naar de hartspier. Deze kortlevende isotoop met een halfwaardetijd van 19,5 dagen straalt gamma-deeltjes uit. Hoewel rubidium giftig is wordt de dosis bij dit onderzoek zo klein gehouden dat er geen problemen ontstaat. Voor onderzoek naar en controle van de bloedsomloop wordt gebruikt gemaakt van het 86Rb-isotoop als tracer.
Hard glas
Glas wordt zeer hard dankzij rubidiumcarbonaat (Rb2CO3) of rubidiumoxide (Rb2O). Het dient dan onder andere als veiligheidsglas. Ook aan glas voor glasvezelkabels wordt rubidiumoxide toegevoegd.
Magnetometers
Het rubidium atoom heeft een enkel buitenste elektron in een baan met een relatief grote afstand tot de kern. Dat maakt rubidium zeer gevoelig voor magnetische velden. Magnetometers dienen onder andere voor het opsporen van aardgasvelden.
Ouderdomsbepaling van gesteente
Natuurlijk rubidium bevat 27,8 % 87Rb. Dat is een langlevende gammastraler met een halfwaardetijd van 4,9 1010 jaar, waaruit 87Sr wordt gevormd. De verhouding 87Rb/87Sr is een maat voor de ouderdom van gesteente.
Meer toepassingen
Als element en in legeringen
- Atoomklok (87Rb met 6,8 GHz)
- Elektronentelbuis
- Kwikschakelaar (Rb-Hg-amalgaam)
- Laser, maser
- Luminifoor
- Thermistor (weerstand met zeer grote temperatuurcoëfficiënt)
- Thermo-elektrische generator
- Werkgas in een gasturbine
In verbindingen
| Fotokathode voor infraroodapparatuur | Rb2CO3 |
| Keramiek | Rb2CO3 |
| Vastestof laser | Rb2CO3 |
| Elektrolyt in brandstofcellen | (RbOH) |
Naam & ontdekking
Naam
Het Latijnse woord rubidus betekent donkerrood. De naam is afgeleid van de dieprode kleur van specifieke spectraallijnen van dit element.

Ontdekking
De Duitsers Robert Wilhelm Bunsen (chemicus, foto) en Gustav Robert Kirchhoff (natuurkundige) toonden het nieuwe element in 1861 aan in het mineraal lepidoliet en in droge dampresten van mineraalwater uit Bad Dürkheim. Om 9 gram rubidiumchloride (RbCl) te verkrijgen, moesten ze meer dan veertigduizend liter mineraalwater bewerken. Bunsen en Kirchhoff maakten gebruik van vlamspectroscopie. Een jaar daarvoor hadden ze op dezelfde wijze al cesium gevonden.
Bunsen isoleerde rubidium in 1861 via elektrolyse van gesmolten rubidiumchloride (RbCl) bij een temperatuur van circa 720 oC.
Voorkomen
Voorkomen
Rubidium staat op plaats 22 in de lijst van meest voorkomende elementen in de aardkorst met een aandeel van 0,009 % naar gewicht.

De voornaamste mineralen met rubidium zijn:
| Carnalliet | KMgCl3.6H2O, met een kleine beetje RbCl. |
| Lepidoliet (foto) | K(Li,Al)3(Si,Al)4O10(F,OH)2, dat tot 3,5 % Rb2O kan bevatten |
| Pulluciet | (Cs,Na)2Al2S4O10, met 1 % Rb2O |
Verder zijn kleine hoeveelheden rubidiumverbindingen onder andere te vinden in mineraalwater (6.10-5 % ), zeewater (2.10-5 %) en verbrandingsresten van suikerbieten, paddenstoelen en tabak.
Het menselijk lichaam bevat ongeveer 1,1 gram rubidium (0,0005%) Het is nog onbekend wat de rol van het element daar is.
Winning
De belangrijkste wingebieden van rubidium liggen in Zimbabwe, Zuid-Afrika, de Verenigde Staten en Rusland.
Bereiding
Bereiding
Vroeger
Robert Bunsen isoleerde rubidium in 1861 via elektrolyse van gesmolten rubidiumchloride (RbCl) bij een temperatuur van circa 720 oC.

Tegenwoordig
Uit mineralen, meestal lepidoliet, zijn rubidiumzouten te isoleren door:
- Neerslaan als rubidiumchloroplatinaat (Rb2PtCl6). Daarbij ontstaan ook kalium- en cesiumverbindingen. Het rubidiumzout is af te zonderen via gefractioneerde kristallisatie.
- Overvoeren van de mineralen in een oplossing van waterstoftartraat, waarna het rubidiumzout is af te zonderen met gefractioneerde kristallisatie.
- Behandeling van lepidoliet met geconcentreerd zwavelzuur, waarbij een neerslag van rubidiumaluin ontstaat.
De zo verkregen zouten zijn zonodig om te zetten in andere rubidium zouten: rubidiumchloride, -cyanide, -carbonaat en -hydroxide. Hieruit is vervolgens rubidium te verkrijgen door: