Deze oefentoets bestaat uit drie vragen over het onderwerp reactiesnelheid en energie.
De uitwerking vind je na het openen van alle hints. Let op, als er geen ‘Controleer antwoord’ knop staat, moet je zelf je antwoord controleren met behulp van de hints en uitwerking.
Vraag 1
André en Robbert willen weten hoeveel J er vrijkomt bij het aansteken van een aansteker. Ze nemen een aansteker en maken er 40 keer een vlammetje mee. Daarna wegen ze de aansteker opnieuw. Deze blijkt 0,15 gram lichter te zijn geworden. Verder hebben ze gevonden dat 2,9·106 joule aan energie vrijkomt bij de volledige verbranding van 1,0 mol C4H10 (aanstekergas).
Vraag 2
Insecten worden vaak opgegeten door andere dieren. Om dit te voorkomen maken insecten gebruik van bijvoorbeeld camouflage. De bombardeerkever gebruikt een wel héél bijzondere manier om vijanden af te schrikken: scheikunde!
Tekstfragment 1:

De explosie wordt veroorzaakt doordat tegelijkertijd twee exotherme reacties plaatsvinden: de ontleding van waterstofperoxide (reactie 1) en de reactie van hydrochinon met waterstofperoxide (reactie 2).
De vergelijkingen van beide reacties zijn hieronder weergegeven:
2 H2O2 → 2 H2O + O2 (reactie 1)
C6H6O2 + H2O2 → C6H4O2 + 2 H2O (reactie 2)
Vraag 3
Waterstofperoxide kan ontleden in water en zuurstof:
2 H2O2 → 2 H2O + O2
Wanneer ook jodide aanwezig is, wordt een versnelde gasontwikkeling waargenomen. Men heeft vastgesteld dat het jodide als katalysator optreedt.
Bert en Dieke hebben een onderzoek uitgevoerd om aan te tonen dat jodide de reactiesnelheid vergroot. Ze gebruikten daarvoor oplossingen van kaliumjodide met verschillende molariteiten. Van de TOA hebben ze een 0,44 M KI oplossing gekregen. Met behulp van deze oplossing moesten ze een 0,33 M KI oplossing maken en een 0,22 M KI oplossing.
Het onderzoek van Bert en Dieke bestond uit drie proefjes met verschillende jodideconcentraties. In onderstaande tabel is de samenstelling van de oplossingen in elk proefje weergegeven.
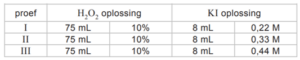
Omdat de ontleding van waterstofperoxide exotherm is, is de snelheid van de ontleding te volgen door voortdurend de temperatuur van het reactiemengsel te meten. Op het moment dat de KI oplossing werd toegevoegd, werd de tijdmeting gestart. Vervolgens werd gedurende 120 seconden de temperatuur van het reactiemengsel gemeten.
In onderstaand diagram is het verloop van de temperatuur van het reactiemengsel voor elk van de drie proefjes weergegeven.
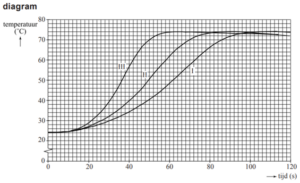
De gemiddelde reactiesnelheid voor de ontleding van waterstofperoxide wordt gedefinieerd als de gemiddelde afname van de [H2O2] per seconde en wordt uitgedrukt in mol L–1 s–1.