
Deze oefentoets bestaat uit vijf vragen over het onderwerp reactiesnelheid.
De uitwerking vind je na het openen van alle hints. Let op, als er geen ‘Controleer antwoord’ knop staat, moet je zelf je antwoord controleren met behulp van de hints en uitwerking.
Vraag 1
10 gram NO2 reageert in een vat van 2,5 liter als volgt:
2 NO2 (g) → N2O4 (g)
Na 60 seconden is 65 % van het aanwezige NO2 omgezet.
Vraag 2
In een vat van 500 cm3 wordt 3,50 mol HCl en 1,40 mol O2 gebracht. De volgende reactie vindt plaats:
4 HCl + O2 → 2 H2O + 2 Cl2
Er wordt 70,0% van het HCl omgezet.
Vraag 3
Men brengt op tijdstip t0 in een ruimte met constant volume een hoeveelheid waterstof met een overmaat chloor.
De volgende reactie vindt dan plaats:
H2 (g) + Cl2 (g) → 2 HCl (g)
Op tijdstip t1 perst men het nog reagerende gasmengsel samen. De temperatuur wordt gedurende proef constant gehouden.
Vraag 4
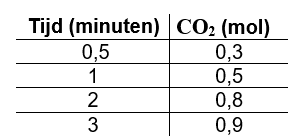
In een open vat van 1,00 liter wordt marmer (calciumcarbonaat) verhit tot 800 K. Er ontstaat koolstofdioxide; de hoeveelheid ervan kan worden bepaald uit de afname van de massa van het residu in het reactie vat. Deze hoeveelheid CO2 is, voor jullie gemak, omgerekend in mol.
Er werd uitgegaan van 1,00 mol CaCO3, waaruit uiteindelijk 1,00 mol CaO ontstaat.
In onderstaande tabel is de hoeveelheid CO2 na een aantal minuten aangegeven.
Vraag 5
Ga voor elk van onderstaande uitspraken na of deze juist of onjuist is. Licht je keuze duidelijk toe.
Je kunt je antwoord checken met de ‘Controleer antwoord’ knop.
Let op: op een toets verwacht een docent de hele uitleg zoals in de uitwerking staat.













