Samarium is een zilverachtig glanzend metaal uit de reeks van de zeldzame aarden. Het is redelijk stabiel in lucht maar bij hogere temperaturen (boven 150°C) vliegt het vanzelf in brand. Je vind samarium vooral in elektronicaproducten, magneten, keramiek en glas.
Symbool
Sm
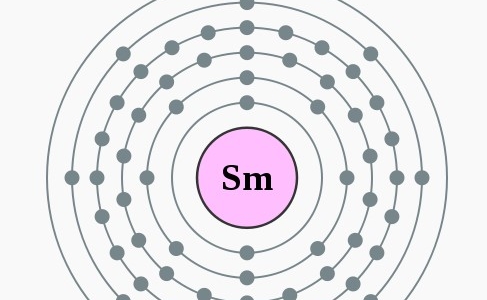
Protonen/elektronen
Groep
Isotopen
144Sm, 147Sm, 148Sm, 149Sm, 150Sm, 152Sm, 154Sm
Periode
6
Elektronenconfiguratie
[Xe] 6s2 4f6
Blok
f
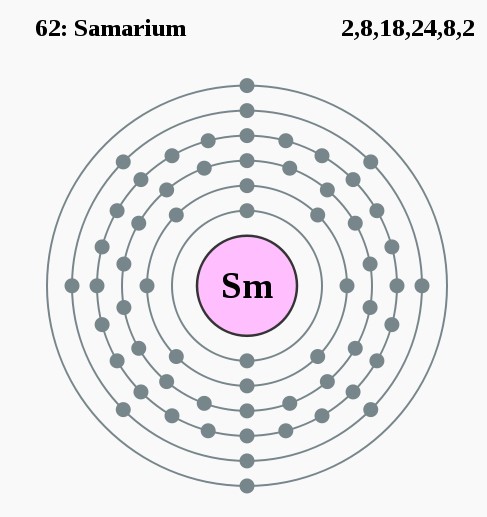
Elektronencofiguratie Bohr
2,8,18,24,8,2
Bij kamertemperatuur
vast
Elektronegativiteit
1,2 (Pauling)
Dichtheid
7530 kg m-3
Atoomstraal
180 . 10-12 m
Smeltpunt
1072 oC (1345 K)
Relatieve atoommassa
150.35
Kookpunt
1791 oC (2064 K)
Soortelijke warmte
196 J kg−1 K−1
Warmtegeleidingscoëfficiënt
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Permanente magneet
Legeringen van zeldzame aarden met metalen als ijzer, kobalt, nikkel en aluminium worden onder andere gebruikt voor permanente magneten. De goede magnetische eigenschappen zijn het gevolg van de aanwezigheid van (meerdere) ongepaarde elektronen.
De beste magnetische samariumlegeringen is SmCo5. Deze legering ontstaat via de gelijktijdige reductie van samarium- en kobaltoxide met calcium:

Magneten van SmCo5 hebben (bij kamertemperatuur) de hoogste weerstand tegen demagnetisatie. Qua magneetsterkte leggen ze het alleen af tegen neodymiummagneten. Je vindt ze onder andere in zeer kleine speakers voor mp3 spelers en smartphones. Sommige elektrische gitaren hebben ‘noiseless’ pick-up elementen (foto) met een samarium-kobalt magneet.

Neutronenvanger
Samarium heeft een zeer grote invangcapaciteit voor thermische neutronen, dat zijn neutronen met een relatief lage bewegingsenergie, geschikt om kernsplijting te veroorzaken in uranium-235. Het dient – gelegeerd aan andere metalen – als neutronenvanger in kernreactoren.
Laser en maser
Samariumverbindingen worden in kleine hoeveelheid toegevoegd aan CaF2 bij het bereiden van CaF2-kristallen voor masers (lasers in het microgolfgebied). Ook voor het doteren van kristallen van lasers is samarium zeer geschikt. Door de verstoring in het rooster ontstaat een ‘geactiveerd kristal’ dat – als er licht of straling op valt – licht van een bepaalde golflengte gaat uitzenden.
Condensator keramiek
Sommige typen condensatoren hebben een diëlektricum van porselein of keramiek. Dit bevat vaak sporen van de oxiden van lanthaan, neodymium of samarium.
Behandeling botkanker
De isotoop 153Sm biedt mogelijkheden voor de behandeling van kankerpatiënten met wijd verspreide uitzaaiingen naar het bot. Het samarium bindt zich specifiek aan plaatsen waar botmetastasen aanwezig zijn en zal dus selectief deze plaatsen bestralen. Dat leidt snel tot reductie van botpijn..
Meer toepassingen
In verbindingen
| Infrarood-absorberend glas | Sm2O3 |
| Infrarood-fosforen | Sm3+ (dotering) |
| Katalysator voor de dehydrogenering van ethanol tot etheen | Sm2O3 |
| Keramisch stralingsschild | Sm2O3 |
| Tandheelkunde (zie 64 – Europium) | Sm2O3 |
| Thermoelektrische generatoren | SmF |
Naam & ontdekking
Naam
De naam samarium is afgeleid van het mineraal waarin het element voor het eerst werd aangetroffen: samarskiet. Dit is weer vernoemd naar de Russische mijnbouwkundige Vasili Samarski-Bokhovets, die het ontdekte in een mijn in de Oeral. Op deze (getrapte) wijze is samarium in feite het eerste element dat naar een persoon is vernoemd.
Ontdekking
De Franse chemicus Paul Emile (François) Lecoq de Boisbaudran ontdekte samarium in 1879 bij de verwerking van samarskiet. Toch bleek het door hem geïsoleerde oxide niet bijzonder zuiver te zijn: het bevatte aanzienlijke hoeveelheden europiumoxide. Pas in 1901 lukte het zijn landgenoot Eugène-Anatole Demarçay (foto) om samarium(oxide) in zuivere toestand te verkrijgen.

Toelichting: Zeldzame aardmetalen
Samarium behoort tot de zeldzame aardmetalen. De groep omvat de elementen scandium (21) en yttrium (39) en de elementen 57 tot en met 71. Die laatste reeks is ook bekend als de lanthaniden (naar het eerste element uit de reeks: lanthaan).
Zeldzaam wil niet zeggen dat de betreffende elementen weinig op aarde voorkomen. Het gaat hier om een groep elementen die allemaal ontdekt zijn via de isolatie van hun oxide. De term ‘zeldzaam’ vindt zijn oorsprong in het feit dat deze oxiden (aarden) bijzonder moeilijk te herkennen en scheiden zijn. Het duurde meer dan een eeuw voordat ze allemaal ontdekt waren. In dezelfde periode werd bijna honderd keer de ontdekking van andere nieuwe elementen geclaimd.
Na verloop van tijd kwam de term ‘zeldzaam’ ook in zwang als aanduiding van de elementen zelf. Ze werden vaak pas vele jaren na hun ontdekking in zuivere vorm geïsoleerd.
De nieuwe oxiden vinden hun oorsprong voor het grootste deel in twee mineralen: gadoliniet en ceriet. Daaruit werden respectievelijk de oxidenmengsels yttria en ceria ontsloten.
Het relatief ‘zware’ mineraal gadoliniet was in 1787 door de Zweedse chemicus Carl Axel Arrhenius ontdekt in een wingebied voor veldspaat bij Ytterby (in de buurt van Stockholm). Het heette eerst ytteriet, vandaar dat het verwerkingsproduct in 1794 yttria werd genoemd. Men beschouwde Yttria aanvankelijk als het oxide van één enkel element; het latere yttrium (Y). Uiteindelijk bleek het een mengsel van zowel yttriumoxide als de oxiden van de zwaardere lanthaniden: gadolinium, terbium, erbium, dysprosium, holmium, thulium, ytterbium en lutetium.
Ceria werd in 1803 voor het eerst bereid uit ceriet, dat in 1751 was gevonden door de Zweedse chemicus/mineraloog Axel Fredrik Cronstedt. Het leverde de oxiden op van lanthaan en de lichtere lanthaniden: cerium, praseodymium, neodymium, samarium, europium.
Tot het einde van de 19e eeuw waren er geen toepassingen voor (verbindingen van) de zeldzame aarden. De Oostenrijkse wetenschapper Carl Auer Freiherr von Welsbach bracht daar verandering in. Hij gebruikte thorium en cesium ter verhoging van de lichtopbrengst van een gasvlam. De gaspitten werden daartoe in een mengsel van thorium– en ceriumnitraat gedompeld. Bij de verbranding ontstaan dan de oxiden. Ceriumoxide katalyseert de verbranding en door de zeer slechte geleidbaarheid van het thoriumoxide werden de deeltjes zeer heet en geven ze een helder licht.
Met de vinding van Von Welsbach kwam zowel het grootschaliger speuren naar de zeldzame aarden als het zoeken naar toepassingen in een stroomversnelling. Inmiddels zijn meer dan 100 mineralen bekend met zeldzame aardmetalen. Deze metalen kennen specialistische toepassingen in allerlei hoogtechnologische (elektronische) apparatuur. China is verreweg de belangrijkste producent van deze elementen.
Voorkomen
Voorkomen
Hoewel er 39 elementen zijn waarvan de aardkost méér bevat dan van samarium, is dit ‘zeldzame’ aardmetaal toch niet echt zeldzaam. Met een gewichtsaandeel van 7,0.10-4 % komt het meer voor dan bijvoorbeeld uranium, tin en cadmium.

De belangrijkste mineralen, die kleine hoeveelheden van dit element bevatten, zijn:
| Allaniet-(Ce) | (Ce, Ca,Y)2(Al,Fe+2, Fe+3)3 (SiO4)3 OH |
| Allaniet-(Y) | (Y,Ce,Ca)2(Al,Fe+3)3(SiO4)3 OH |
| Bastnaesiet-(Ce) | (Ce,La)CO3F |
| Bastnaesiet-(Y) | (Y,La)CO3F |
| Euxeniet-(Y) | (Y,Ca,Ce,U,Th)(Nb,Ti,Ta)2O6 |
| Monaziet-(Ce) | (Ce,La,Nd,Th)PO4 (ca 2,8%) |
| Monaziet-(La) | (La,Ce,Nd)PO4 |
| Monaziet-(Nd) | (Nd,La,Ce)PO4 |
| Samarskiet-(Y) (foto) | (Y,Ce,U, Fe+3)(Nb,Ta,Ti)5O16 |
Winning
De belangrijkste wingebieden liggen in Australië, China, Mongolië, India, Brazilië, de Verenigde Staten van Amerika, Maleisië, Rusland, Tanzania, Burundi, Zambia, Madagaskar, Noorwegen, Zweden en Canada.
Bereiding
Bereiding
Vroeger
Samarium behoort tot de lanthaniden en de zeldzame aarden. Deze werden oorspronkelijk gescheiden op grond van de uiterst kleine verschillen in oplosbaarheid van de metaalhydroxiden en -oxiden in loog. Ook bleek het mogelijk te scheiden op basis van de oplosbaarheid van hun zouten, voornamelijk de oxalaten en sulfaten (met name Ln2(SO4)3.Na2SO4.xH2O, met Ln als symbool voor de lantaniden). De oplosbaarheid neemt licht toe naarmate de atoommassa van het lanthanide toeneemt.
De verschillen zijn echter zo klein dat voor een redelijke scheiding vele malen herkristalliseren nodig is. Duizend maal is daarbij geen uitzondering. Om een geringe hoeveelheid zuiver thuliumbromaat te verkrijgen werd bijvoorbeeld zelfs tot vijftienduizend keer geherkristalliseerd.

Tegenwoordig
Na 1950 maakten moderne scheidingsmethoden het makkelijker de zouten van de zeldzame aarden in redelijke hoeveelheden te scheiden. Continue vloeistofextractie bijvoorbeeld, waarbij de waterige oplossing van de zouten wordt geëxtraheerd met tri-n-butylfosfaat. Een andere methode is ionenwisseling, die zouten met een hoge zuiverheid oplevert en doorgaans op wat kleinere schaal wordt toegepast
De nieuwe scheidingstechnieken dienden in de eerste plaats voor de productie van goede splijtstof voor kernreactoren. Daarbij is het van belang uraan- en thoriumertsen te ontdoen van alle sterk neutronen remmende elementen, zoals de lanthaniden. Dit stimuleerde vervolgens ook het zoeken naar toepassingen en daarmee kwam ook een bredere zoektocht naar zeldzame aarden op gang.
Winning uit erts
Het mineraal monaziet bevat (naast 5 – 10 % thoriumoxide, ThO2) enkele procenten van de oxiden uit de zogenaamde yttria-groep (zie tabblad Naam&Ontdekking); andere lanthaniden komen in veel mindere mate voor. Bastnaesiet en allaniet bevatten enkele procenten van – voornamelijk – de oxiden van cerium, lanthaan, neodymium en praseodymium.
Om de lanthaniden te verkrijgen behandelt men het erts, bijvoorbeeld monaziet, met geconcentreerd zwavelzuur bij 200 °C. Daarbij ontstaat een oplossing van de sulfaten van lanthaan, thorium en de aanwezige lanthaniden. Na toevoegen van ammonia slaat eerst het thoriumzout neer. Na toevoegen van natriumsulfaat slaan vervolgens de zouten van de lichtere lanthaniden neer. Na scheiding van de diverse zouten volgt zuivering.
De bereiding van de elementen in zuivere vorm verloopt meestal via elektrolyse van gesmolten zouten. Een andere mogelijkheid is de reductie van oxiden met lanthaan of calcium, of van fluoriden en chloriden met calcium, kalium of natrium. Daarbij wordt het zout gesmolten in een tantalen kroes, gevolgd door reductie (in vacuüm of in een argonatmosfeer) met bijvoorbeeld calciumdamp. Bij samarium levert reductie van het oxide met barium of lanthaan de beste resultaten.