
Deze oefentoets bestaat uit zes vragen over het onderwerp bindingen.
De uitwerking vind je na het openen van alle hints. Let op, als er geen ‘Controleer antwoord’ knop staat, moet je zelf je antwoord controleren met behulp van de hints en uitwerking.
Vraag 1
Vraag 2
Tijdens een practicum wordt een onbekende stof onderzocht. De resultaten zijn als volgt:
- De stof heeft een hoog (± 1500K) smeltpunt.
- In gesmolten toestand geleid de stof elektrische stroom.
Vraag 3
Stofeigenschappen zijn eigenschappen op macro-niveau die te verklaren zijn door te kijken naar de eigenschappen op micro-niveau (de bindingen tussen atomen, ionen en moleculen).
Leg de volgende beweringen op macro-niveau uit door een beschrijving te geven van de stoffen op micro-niveau.
Vraag 4
Waterstofhypochloriet (HOCl) heeft de structuurformule die hieronder afgebeeld is.
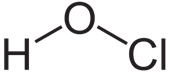
Vraag 5
Waterstofhypochloriet (HOCl) heeft de structuurformule die hieronder afgebeeld is.

Grafeen is een laagje koolstofatomen van slechts één atoom dik. In de afbeelding hieronder is de structuur van grafeen weergegeven. Elk bolletje is een koolstofatoom en elk staafje tussen bolletjes is een atoombinding.

Figuur 1
Grafeen geleidt elektrische stroom. Als elk staafje dat in figuur 1 is getekend een enkele atoombinding voorstelt, dan kan de stroomgeleiding in grafeen verklaard worden door de aanwezigheid van elektronen die niet betrokken zijn bij deze bindingen tussen de C atomen.
Vraag 6
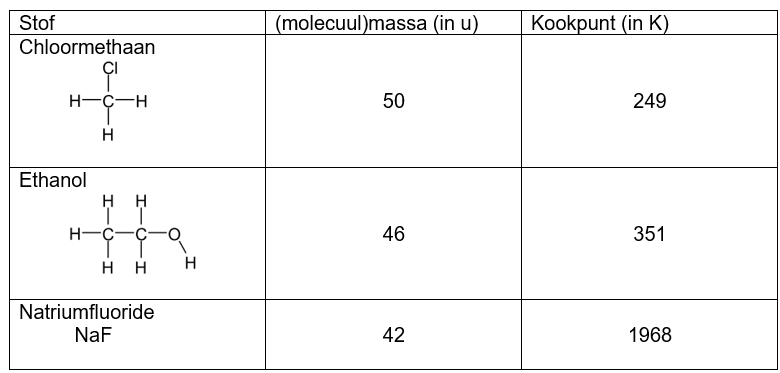
Een leerling trekt aan de hand van bovenstaande tabel de volgende conclusie: “Hoe lager de massa, hoe hoger het kookpunt.”













